Per avere l’autorizzazione per il vaccino di AstraZeneca e Oxford bisognerà ancora aspettare: la doccia fredda arriva dal vice direttore esecutivo dell’Agenzia europea del farmaco, Noel Wathion, che in un’intervista al quotidiano belga Het Nieuwsblad ha definito “improbabile” un via libera dell’Ema a gennaio. “Non hanno ancora fatto domanda”, ha aggiunto Wathion, sottolineando che “servono altri dati sulla qualità del vaccino”. Secondo l’analisi dello studio sul protocollo della Fase 3 (pubblicato sul sito clinicaltrials.gov che rende pubblici tutti i dati sulle sperimentazioni cliniche), ci sono stati errori metodologici nella prima sperimentazione del vaccino di AstraZeneca e Oxford. Questa sarebbe la ragione dietro al probabile rinvio deciso dall’Ema. Il problema “non sembra riguardare problemi correlati alla sicurezza, ma piuttosto all’efficacia valutata con un protocollo poco lineare“, rileva il virologo Francesco Broccolo, dell’Università di Milano Bicocca. Nel frattempo, l’ente regolatore della Gran Bretagna, Mhra, dovrebbe autorizzare a breve il farmaco e gli inglesi sperano di poter cominciare la distribuzione già il 4 gennaio. Una notizia che aveva fatto sperare anche l’Europa: dopo l’avvio della vaccinazione con le fiale di Pfizer, è atteso per il 6 gennaio anche il via libera dell’Ema al farmaco realizzato da Moderna.
L’Unione europea acquisterà altri 100 milioni di dosi del vaccino Pfizer e BionTech – Nel frattempo, l’Unione europea ha deciso di acquistare altri 100 milioni di dosi del vaccino Pfizer e BionTech. A dare l’annuncio è la presidente della Commissione europea Ursula von der Leyen con un post su Twitter. “Avremo in totale 300 milioni di dosi di questo vaccino, che è stato giudicato sicuro ed efficace e che già viene usato per vaccinare le persone in tutta l’Ue. Seguiranno gli altri vaccini”. Anche il commissario europeo all’Economia, Paolo Gentiloni, ha supportato la scelta: “Giusta la decisione di acquistare altri 100 milioni di dosi del vaccino contro la Covid-19 sviluppato da Pfizer e BionTech, oltre ai 200 milioni iniziali – ha scritto su Twitter – È l’unico già autorizzato e in distribuzione“, ha sottolineato.
“Per l’Italia il vaccino di AstraZeneca e Oxford renderà tutto più semplice”: l’hub di Pratica di Mare – Le parole del vice direttore esecutivo dell’Ema sono una brutta notizia in particolare per l’Italia. Il vaccino di AstraZeneca e dell’Università di Oxford è sviluppato in collaborazione con l’azienda italiana Irbm di Pomezia. “Il vettore virale è prodotto a Pomezia, nell’impianto Irbm, l’infialamento avviene ad Anagni e la conservazione delle dosi non ha bisogno di temperature a 75 sotto zero. Vuol dire che per noi, sfruttando Pratica di Mare come hub, sarà tutto più semplice: produzione, distribuzione, conservazione”, spiegava lunedì il ministro della Salute, Roberto Speranza. Lo stesso Speranza aveva sottolineato perché per l’Italia è cruciale il via libera al vaccino di AstraZeneca e Oxford: “Se arriva subito al traguardo, entro il primo trimestre si aggiungeranno altre 16 milioni di dosi, che corrispondono ad altre 8 milioni di persone vaccinate. Risultato finale: noi già dal primo aprile potremmo avere 13 milioni di vaccinati e così avremmo già raggiunto la Fase Uno, cioè quella che ci consente di avere il primo impatto epidemiologico”.
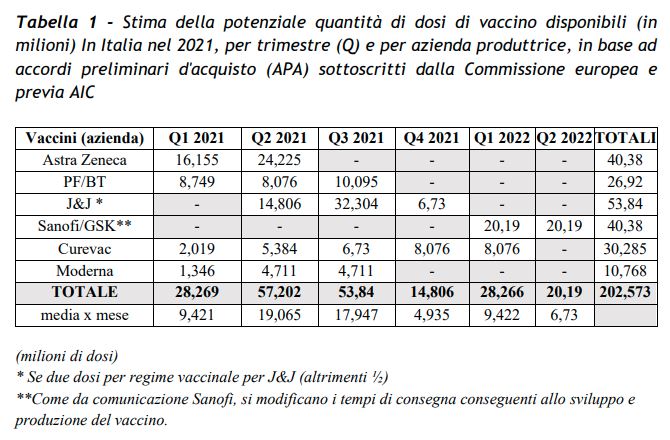
Il Piano strategico del governo per la vaccinazione in Italia: 16 milioni di dosi entro marzo – L’obiettivo delle 13 milioni di persone immunizzate in tre mesi sarebbe a rischio se ci fossero ulteriori ritardi nell’autorizzazione degli altri vaccini. Come scritto nel Piano strategico del governo, l’Italia avrà 40,4 milioni di dosi AstraZeneca, 26,9 milioni Pfizer/Biontech, 50,8 milioni Johnson&Johnson, 40,4 milioni Sanofi/GSK, 30,9 milioni Curevac, 10,8 milioni Moderna. La cifra totale corrisponde al 13,46% delle circa 200 miliardi di dosi acquisite a livello europeo. Ma anche le tempistiche sono cruciali: Pfizer/Biontech ha già ricevuto il via libera, Moderna è in dirittura d’arrivo. Gli altri? La potenziale quantità di dosi di vaccino disponibili stimata dal governo nel Piano strategico prevede, come ha spiegato Speranza, che da AstraZeneca arrivino 16 milioni di dosi nel primo trimestre, poi altre 24 milioni nel secondo trimestre (tra aprile e giugno). In totale corrispondono a poco meno della metà delle dosi totali che il governo stima di avere a disposizioni nei primi sei mesi del 2020 (28 milioni nel primo trimestre, 57 milioni nel secondo).
“Errori metodologici” nella prima sperimentazione di AstraZeneca: le cause del probabile rinvio – Errori metodologici nella prima sperimentazione del candidato vaccino di AstraZeneca e Oxford sono all’origine della dichiarazione dell’Ema per cui è ‘improbabile’ il via libera entro gennaio. È quanto emerge dall’analisi del nuovo protocollo relativo allo studio della Fase 3. Per il farmacologo Carlo Centemeri, della Giovanni Lorenzini Medical Foundation MI-NY, la “sicurezza e tollerabilità del vaccino di AstraZeneca/Oxford restano fuori discussione“. Dai dati relativi allo studio di fase III del candidato vaccino di AstraZeneca emergerebbe che la sperimentazione era partita nel marzo scorso con una dose piena e che soltanto in un secondo tempo, alla luce dei dati relativi alla copertura immunitaria, è stata introdotta una seconda dose, inoculata in tempi diversi, rendendo in questo modo molto complesso confrontare i dati. Inoltre, per errore, è accaduto che su un certo numero di soggetti la prima dose è stata somministrata a metà. Per questa serie di difficoltà il 28 agosto è iniziata una nuova terza fase di sperimentazione, che prevede la somministrazione di due dosi piene del candidato vaccino a distanza di 21 giorni su 40 mila persone. “È molto difficile – osserva Centemeri – che l’Ema possa dare la propria approvazione entro gennaio, poiché i dati appaiono non sufficientemente consistenti. Auspicabilmente – aggiunge l’esperto – la valutazione da parte di Ema potrebbe arrivare nei mesi successivi a gennaio 2021″.
“Non è stata presentata la domanda per l’autorizzazione”: la spiegazione dell’Agenzia del farmaco europea – Il vice direttore esecutivo dell’Ema Wathion al quotidiano belga Het Nieuwsblad ha spiegato anche che l’Ema non dispone al momento di informazioni sufficienti sul vaccino, visto che “AstraZeneca ha fornito solo dati sui propri studi clinici“, e questi “non sono sufficienti” per concedere un’autorizzazione all’immissione in commercio condizionata. “Abbiamo bisogno di dati aggiuntivi sulla qualità del loro vaccino”, ha aggiunto Wathion. Inoltre, ha sottolineato, AstraZeneca deve ancora presentare una domanda formale, che è un’altra condizione necessaria per dare il via libera al vaccino. Nel frattempo, però, il Regno Unito prevede di lanciare il vaccino AstraZeneca-Oxford dal 4 gennaio. Per quanto riguarda il motivo per cui sarebbe stato autorizzato lì, “siamo all’oscuro, perché non sappiamo quali dati AstraZeneca ha presentato alle autorità britanniche”, ha detto Wathion. “Ma potrebbe anche essere che l’agenzia britannica stia concedendo un’autorizzazione provvisoria“, che consentirebbe solo la distribuzione di determinati lotti del vaccino. “Non lo facciamo, perché l’azienda deve prima dimostrare che tutti i vaccini saranno di alta qualità“, ha aggiunto il vice direttore esecutivo dell’ente regolatorio Ue. AstraZeneca è stata la prima azienda farmaceutica a firmare un contratto con la Commissione europea, per un totale di 300 milioni di dosi, con un’opzione per ulteriori 100 milioni.
Articolo Precedente
Vaccini anti Covid, rinviate le consegne di Pfizer. Arcuri: “Aggiornato il calendario, le dosi arriveranno in Italia in serata”

Articolo Successivo
Terremoto di magnitudo 4.4 nella zona di Verona: la scossa avvertita anche a Milano






