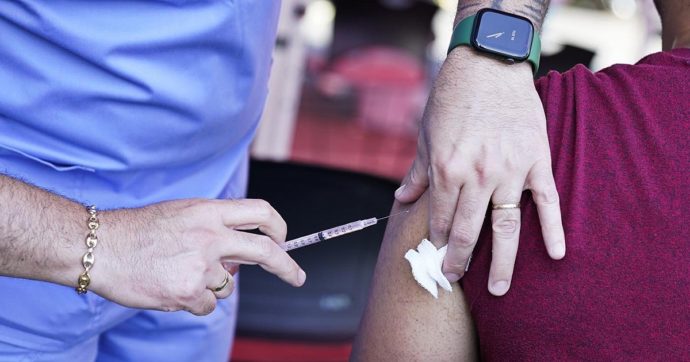
Dopo il via libera della Food and drug administration anche l’Agenzia europea del farmaco (Ema) dà il via libera all’uso ridotto del vaccino contro il Monkeypox (vaiolo delle scimmie) a causa della scarsità delle dosi. La task force di emergenza dell’Ema, ha esaminato i dati sul vaccino Imvanex usato con iniezione intradermica. Il vaccino è autorizzato ora solo per iniezione sottocutanea, ma per via intradermica può esserne utilizzata una dose minore, e data la fornitura limitata del vaccino, più persone possono essere vaccinate. “Le autorità nazionali possono decidere come misura temporanea di utilizzare Imvanex come iniezione intradermica a una dose più bassa per proteggere le persone a rischio durante l’attuale epidemia di vaiolo delle scimmie, mentre la fornitura del vaccino rimane limitata”, segnala l’Agenzia.
La task force dell’Agenzia europea del farmaco ha esaminato i dati di uno studio clinico che ha coinvolto circa 500 adulti, che ha confrontato il vaccino somministrato per via intradermica o sottocutanea, come 2 dosi con un intervallo di 4 settimane tra ciascuna dose. Le persone che hanno ricevuto il vaccino per via intradermica hanno ricevuto un quinto (0,1 ml) della dose sottocutanea (0,5 ml), ma hanno prodotto livelli di anticorpi simili a quelli che hanno ricevuto la dose sottocutanea più elevata. La task foce ha avvertito che esiste un rischio maggiore di reazioni locali (come arrossamento di lunga durata e ispessimento o scolorimento della pelle) dopo le iniezioni intradermiche.
L’emergency task force ha anche osservato che non sono disponibili informazioni sul numero massimo di dosi da 0,1 ml che possono essere prelevate dalla confezione attualmente autorizzata (0,5 ml di sospensione) e ha raccomandato l’uso di siringhe a basso volume per ottimizzare le dosi. L’unità dell’Ema ha anche sottolineato l’importanza di somministrare correttamente le iniezioni intradermiche, raccomandando che solo gli operatori sanitari con esperienza nella somministrazione di iniezioni per via intradermica somministrino il vaccino in questo modo. Imvanex è stato autorizzato per la prima volta in circostanze eccezionali nel 2013 per la protezione contro il vaiolo. A seguito di una domanda per estenderne l’uso, è stato autorizzato per la protezione contro il vaiolo delle scimmie il 22 luglio 2022. Il parere dell’Emergency task force è stato emesso per affrontare l’epidemia di vaiolo delle scimmie in diversi paesi dell’Ue nel contesto delle sue attività di risposta alle emergenze di salute pubblica, che includono la consulenza a sostegno delle attività di regolamentazione e delle valutazioni relative ai prodotti.
Nei giorni scorsi a seguito della decisione della Fda un funzionario anonimo di Bavarian Nordic, l’azienda danese produttrice del vaccino, aveva espresso al Washington Post i timori per questo autorizzazione del prodotto. L’azienda nei giorni scorsi ha fatto sapere è certa di soddisfare la domanda crescente di vaccino e sta valutando la possibilità di esternalizzare parte della produzione, compreso il trasferimento di tecnologia a un produttore a contratto statunitense, per soddisfare la domanda. Intanto salgono a 689 i casi confermati di vaiolo delle scimmie in Italia come evidenzia l’ultimo bollettino del ministero della Salute, segnalando un aumento di 27 casi dall’ultima rilevazione dello scorso 16 agosto. I casi collegati a viaggi all’estero sono 190. L’età mediana dei pazienti è di 37 anni: si tratta di 679 maschi e 10 femmine. Il maggior numero di casi si registra in Lombardia (297), Lazio (125) ed Emilia Romagna (72). In Italia e in altri paesi la vaccinazione è già possibile ed offerta alle persone considerate maggiormente a rischio.
Articolo Precedente
Centaurus, l’Oms: “La variante BA.2.75 di Omicron più patogena. Si replica più facilmente nelle cellule polmonari”

Articolo Successivo
Vaiolo delle scimmie, sulla prevenzione non abbiamo imparato nulla dal Covid