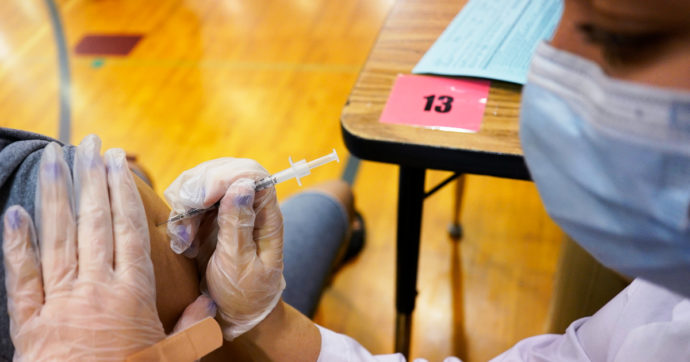
In un parere appena pubblicato, l’Agenzia italiana del farmaco (Aifa) ha approvato il ciclo vaccinale “misto”, cioè composto di due dosi di vaccino diverse, per i soggetti under 60 che abbiano ricevuto una prima dose di Vaxzevria (il nuovo nome commerciale del vaccino Oxford-AstraZeneca). “Sulla base di studi clinici pubblicati nelle ultime settimane, la Commissione tecnico-scientifica – si legge nel documento – ha ritenuto, a fronte di un rilevante potenziamento della risposta anticorpale e un buon profilo di reattogenicità, di approvare il mix vaccinale” tra il composto a vettore adenovirale di AstraZeneca (in prima dose) e quelli a Rna messaggero di Pfizer-BioNTech e Moderna (in seconda). È in corso di pubblicazione in Gazzetta Ufficiale la determina attuativa. Venerdì 11 giugno il Comitato tecnico-scientifico di supporto al Governo aveva dato indicazione di evitare la somministrazione di AstraZeneca ai più giovani di 60 anni e usare – per le seconde dosi già in calendario – proprio Pfizer e Moderna.
La Commissione tecnico-scientifica dell’Aifa si è riunita il 13 giugno 2021 e “si è espressa sulle modalità di utilizzo della schedula vaccinale mista in soggetti al di sotto dei 60 anni di età che hanno ricevuto una prima dose di vaccino Vaxzevria, anche in considerazione del mutato scenario epidemiologico di ridotta circolazione virale”, recita il parere. Oltre che dalla plausibilità biologica, la vaccinazione eterologa è sostenuta dai dati clinici “che derivano da due studi pubblicati nelle ultime settimane condotti rispettivamente in Spagna (CombiVacS) e in Inghilterra (Shaw RH, Lancet 2021) e che mostrano buoni risultati in termini di risposta anticorpale (CombiVacS) e sicurezza (in termini di accettabilità degli effetti collaterali)”.
“In considerazione delle evidenze che si sono appena rese disponibili, dell’attuale assenza di specifiche indicazioni nel Riassunto delle caratteristiche del prodotto (Rcp) dei farmaci in oggetto e della necessità di consentire il regolare svolgimento della campagna vaccinale“, la Commissione ha espresso parere favorevole “all’inserimento nell’elenco dei farmaci di cui alla legge 648/1996 (rimborsabili dal Servizio sanitario nazionale, ndr) di Comirnaty (Pfizer-BioNTech, ndr) e vaccino Covid-19 Moderna come seconda dose per completare un ciclo vaccinale misto, nei soggetti di età inferiore ai 60 anni che abbiano già effettuato una prima dose di vaccino Vaxzevria”. La Commissione ha ritenuto che la seconda somministrazione con vaccino a Rna messaggero possa avvenire a distanza di 8-12 settimane dalla somministrazione di Vaxzevria.
Articolo Precedente
Coronavirus, i dati – Meno di mille contagi in 24 ore con quasi 80mila tamponi: tasso di positività stabile all’1,1%. Altre 36 vittime

Articolo Successivo
Bari, 54enne in rianimazione: “Ischemia dopo vaccino”. Era in cura per “trombosi venosa periferica”. Il 26 maggio immunizzato con J&J