Svelato il punto debole del “fungo killer”, lo studio su Nature sulla fatale Candida auris
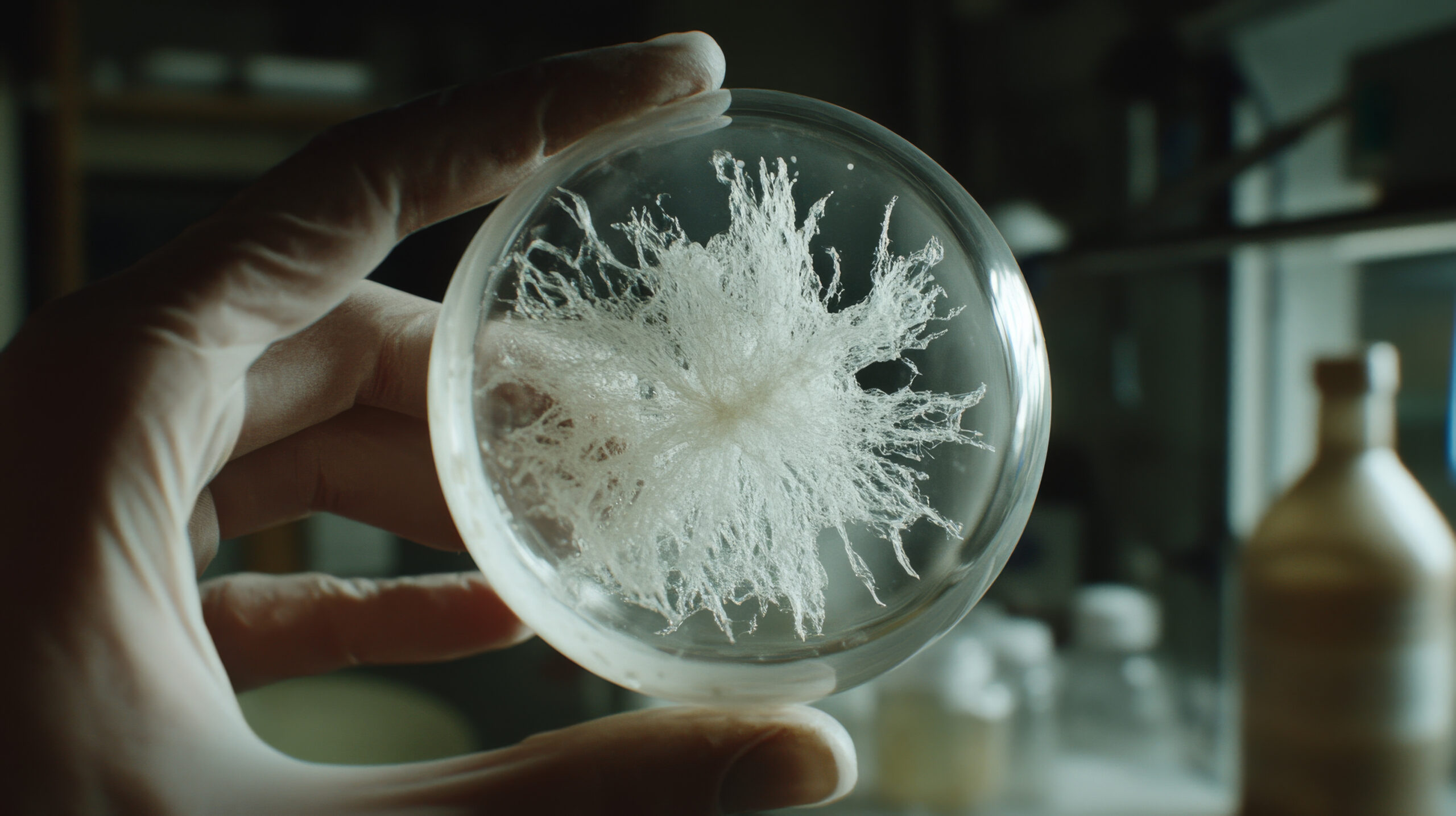
La sua origine rimane misteriosa, ma alcune caratteristiche biologiche – come la resistenza alle alte temperature e a elevate concentrazioni di sale – hanno suggerito ai ricercatori un possibile legame con ambienti marini tropicali.
Un piccolo fungo, invisibile a occhio nudo, ma capace di seminare devastazione nei reparti ospedalieri, potrebbe avere finalmente un punto vulnerabile. È la Candida auris, chiamato anche il “fungo killer”, che ha fatto irruzione nelle cronache mediche negli ultimi anni per la sua capacità di resistere a tutti i principali farmaci antimicotici e provocare infezioni mortali, con un tasso di mortalità del 45% tra i pazienti più fragili, soprattutto quelli sottoposti a ventilazione meccanica.
Da quando è stata identificata per la prima volta nel 2008, la Candida auris ha causato epidemie in oltre 40 Paesi, diventando una minaccia globale inserita dall’Organizzazione mondiale della sanità tra i patogeni fungini di priorità critica e da diversi anni monitorato dalle autorità sanitarie statunitensi. La sua origine rimane misteriosa, ma alcune caratteristiche biologiche – come la resistenza alle alte temperature e a elevate concentrazioni di sale – hanno suggerito ai ricercatori un possibile legame con ambienti marini tropicali.
Ora, uno studio pubblicato sulla rivista Nature Communications Biology dal team dell’Università di Exeter apre una nuova prospettiva. I ricercatori hanno utilizzato le larve del pesce Arabian killifish, il cui sviluppo tollera la temperatura corporea umana, per osservare come il fungo si comporta in un ospite vivente. Hanno scoperto che la Candida auris può trasformarsi in filamenti allungati per cercare nutrienti e hanno identificato quali geni vengono attivati e disattivati durante l’infezione. Alcuni di questi geni sono coinvolti nella ricerca e nell’acquisizione del ferro, suggerendo possibili vulnerabilità sfruttabili dai farmaci.
“Finora non avevamo idea di quali geni fossero attivi durante l’infezione di un ospite vivente – spiega Rhys Farrer, coautore dello studio – Conoscere questo ci offre indizi sulla possibile origine del patogeno e, soprattutto, ci indica potenziali bersagli per nuovi farmaci o per il riutilizzo di farmaci esistenti”. Hugh Gifford, co-direttore del Centro di micologia medica di Exeter, sottolinea l’urgenza di ulteriori ricerche: “Abbiamo identificato un possibile punto debole del patogeno letale. Ora dobbiamo verificare se possiamo sviluppare trattamenti che lo sfruttino e prevenire che continui a mietere vittime nei reparti ospedalieri”.
Il modello delle larve di pesce, finanziato dal progetto, rappresenta un’alternativa ai tradizionali modelli animali come topi e zebrafish. “Ci permette di osservare eventi cellulari e molecolari in ospiti vivi, senza precedenti”, commenta Katie Bates, responsabile dei finanziamenti per la ricerca presso NC3Rs (National Center for Replacement, Reduction and Refinement). La scoperta offre una prospettiva promettente per contrastare un microrganismo che, fin dalla sua comparsa, ha messo in crisi le terapie intensive e le strategie ospedaliere di controllo delle infezioni. Se confermata, potrebbe segnare l’inizio di nuovi approcci terapeutici capaci di proteggere i pazienti più vulnerabili e ridurre l’impatto negli ospedali di tutto il mondo.